常见的金属腐蚀形态及防护措施(二)
金属局部腐蚀主要类型
电偶腐蚀 点蚀(孔蚀)
缝隙腐蚀(丝状腐蚀) 晶间腐蚀
选择性腐蚀 应力腐蚀开裂
腐蚀疲劳 磨损腐蚀
剥蚀 氢损伤
三、缝隙腐蚀
.定义:Crevice Corrosion
-在金属与金属及金属和非金属之间构成狭窄的缝隙内,有电解质溶液存在,介质的迁移受到阻滞时产生的一种局部腐蚀形态
.缝隙腐蚀发生的几何条件
-缝隙
-宽到溶液能够流入缝隙内
-窄到能维持液体在缝内停滞
-最敏感的缝宽约为0.025-0.1mm。
缝隙种类
●机器和设备上的结构缝隙
●固体沉积(泥沙、腐蚀产物等)与金属基体形成的缝隙。
●金属表面的保护模 (如瓷漆、清漆、磷化层、金属涂层)与金属基体之间形成的缝隙。

缝隙腐蚀特征
1.可发生在所有的金属和合金上,特别容易发生在靠钝化耐蚀的金属材料表面。
2.介质可以是任何酸性或中性的侵蚀性溶液,而含有Cl-的溶液最易引发缝隙腐蚀。
3.与点蚀相比,缝隙腐蚀更容易发生。当Eb<E<Ep时,原有的蚀孔可以发展,但不会产生新的蚀孔;而缝隙腐蚀在该电位区间内,既能发生,又能发展。缝隙腐蚀的临界电位比点蚀电位低。
缝隙腐蚀机理
.腐蚀前
缝内外的金属表面发生相同的阴、阳极反应
阳极反应:
阴极反应: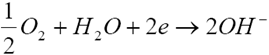
.腐蚀起始阶段
缝内缺氧,缝外富氧,形成了“供氧差异电池”
.腐蚀加速阶段
缝隙几何形状及产物堆积形成“闭塞电池”
“闭塞电池”引起的酸化自催化作用
1.在整个表面均匀发生阳极和阴极反应
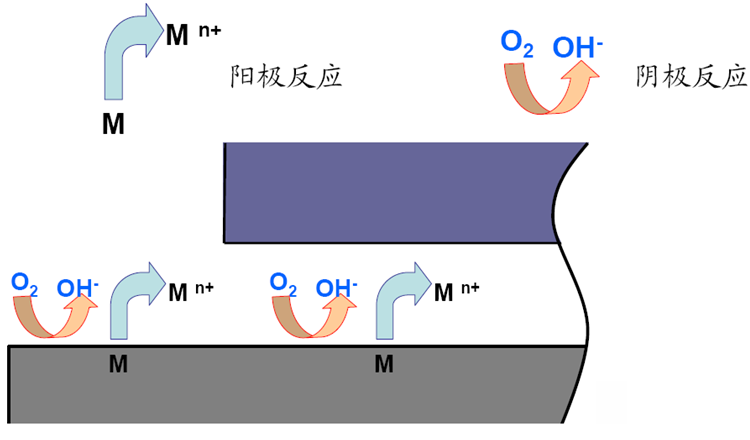
2.缝隙内氧浓度降低,氧还原反应终止;缝隙外供氧充分,氧还原反应继续进行
构成氧浓差电池!缝内阳极,缝外阴极
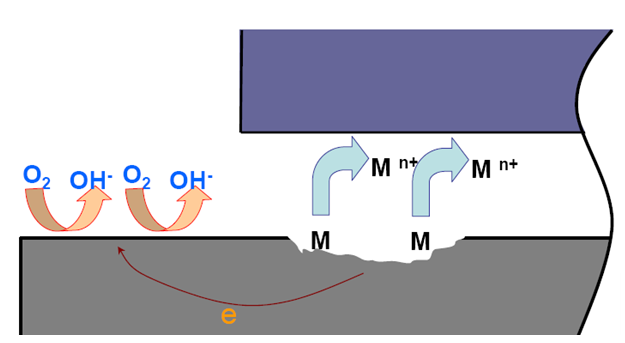
3.缝隙内 ![]() 缝隙外
缝隙外![]()
.大阴极-小阳极:缝隙内腐蚀电流密度很大
.在缝隙口容易形成二次腐蚀产物沉淀 --> 闭塞电池
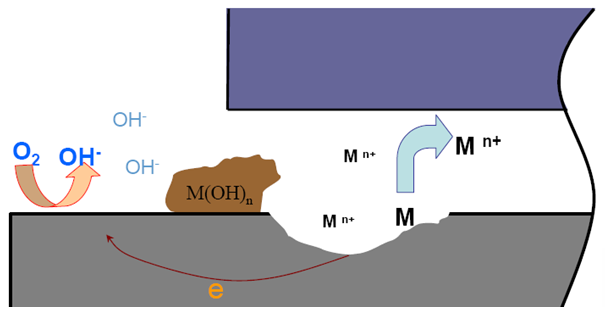
4.闭塞电池形成:
.缝隙内金属离子难以迁出,正电荷过剩
.吸引缝隙外Cl-进入缝隙,以保持电荷平衡
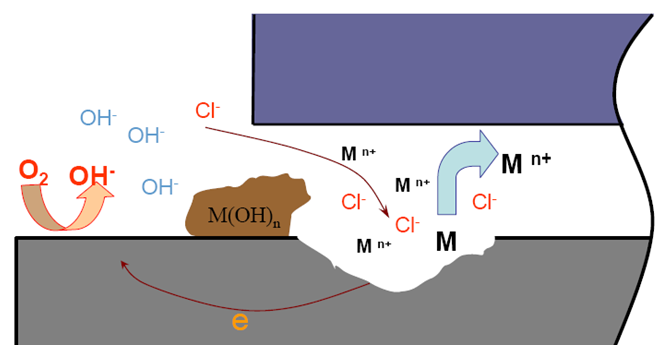
5.缝隙内高浓度氯化物水解
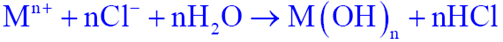
.缝隙内介质严重酸化,pH~3,加速阳极溶解
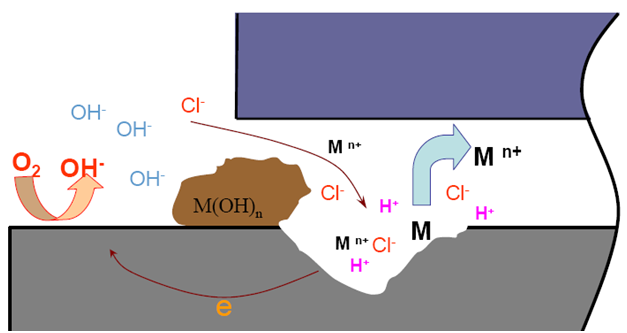
6.阳极加速溶解,又引起更多Cl-迁入,氯化物浓度增加,氯化物水解又使介质进一步酸化,又使阳极溶解:往复循环
.形成闭塞电池内的自催化溶解过程
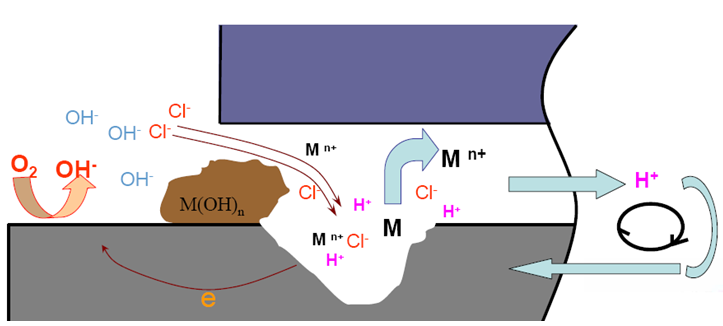
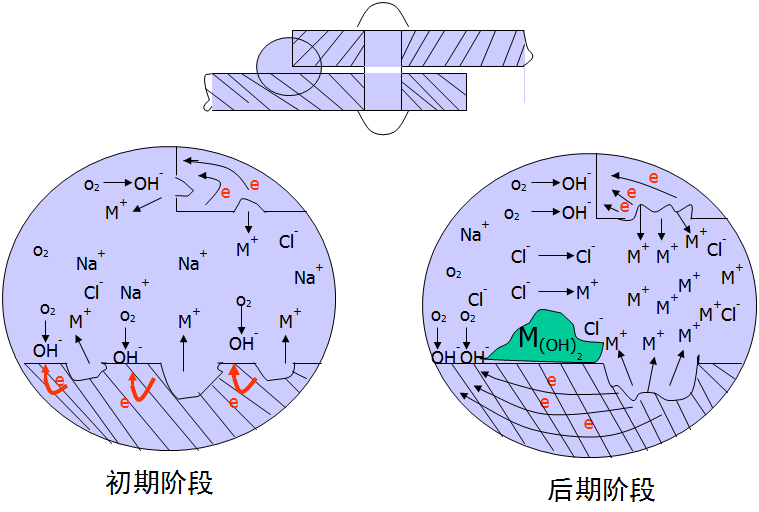
金属在海水中(中性氯化物溶液)缝隙腐蚀
影响因素
●缝隙的几何因素
-缝隙腐蚀与缝外面积有关
-外部面积增大,缝缝内腐蚀严重
-缝外-缝内:大阴极-小阳极
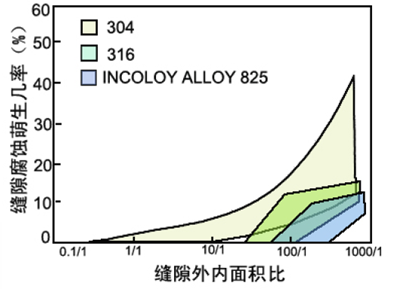
●环境因素
1.溶液中溶解的氧浓度:
.氧浓度增加,缝外阴极还原反应更易进行,缝隙腐蚀加剧
2.溶液中Cl-浓度:
.Cl-浓度增加,电位负移,缝隙腐蚀加速
3.温度:
.温度升高加速阳极反应
.在敞开系统的海水中,80℃达到最大腐蚀速度,高于80℃时,由于溶液的溶氧下降,缝隙腐蚀速度下降。
.在含氯离子的介质中,各种不锈钢存在一个临界缝隙腐蚀温度
4.pH:
-只要缝外金属能够保持钝态,pH降低,缝隙腐蚀量增加。
5.腐蚀介质的流速:
-流速有正、反两个方面的作用
-当流速适当增加时,增大了缝外溶液的含氧量,缝隙腐蚀加重
-对于由沉积物引起的缝隙腐蚀,流速加大,可能将沉积物冲掉,缝隙腐蚀减轻
缝隙腐蚀控制措施
1.合理设计:避免缝隙的形成最能有效地预防缝隙腐蚀的发生。
2.选材:根据介质的不同选择适合的材料可以减轻缝隙腐蚀。
3.电化学保护:阴极保护有助于减轻缝隙腐蚀。
4.应用缓蚀剂:采用足量的磷酸盐、铬酸盐和亚硝酸盐的混合物,对钢、黄铜和Zn结构是有效的,也可以在结合面上涂有加缓蚀剂的油漆。
合理设计
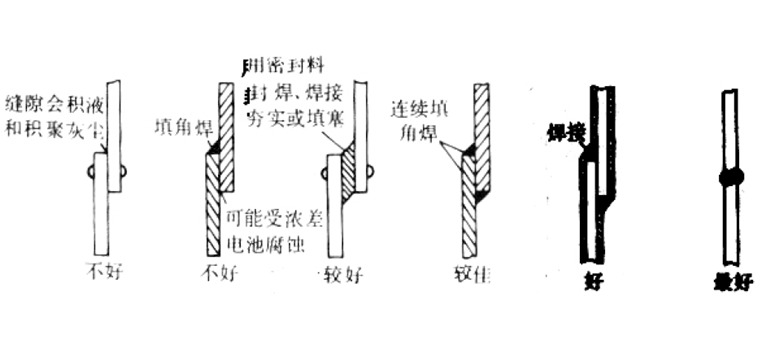
(a)垫圈在零件边缘凸出,垫圈下易形成缝隙腐蚀
(b)垫圈小时,易形成脏物下的缝隙腐蚀
(c)尺寸大小合适
(d)与加缓蚀剂的玛蹄脂层相结合的垫圈
(e)环形密封圈
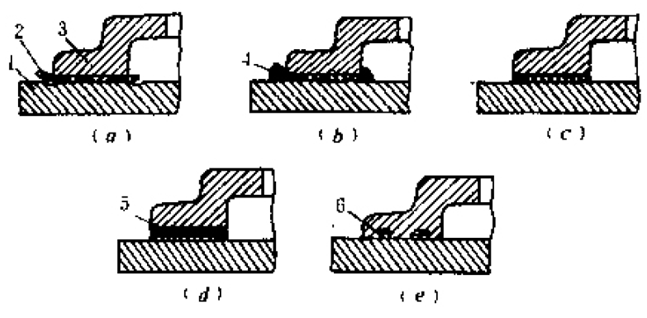
孔蚀和缝隙腐蚀的比较
相似:成长机理一致——闭塞电池
.由于几何形状或腐蚀产物在缝隙、蚀坑或裂纹出口处的堆积,使腐蚀介质流动的通道闭塞
.腐蚀介质扩散受阻,使腔内介质组分、浓度和pH值与整体介质差异很大,形成闭塞电池
不同:形成过程不同
.缝隙腐蚀:
-腐蚀前缝隙已经存在,腐蚀一开始就是闭塞电池作用,闭塞程度大
-由于介质的浓差引起
-形态广而浅
-更易发生
.点蚀:
-腐蚀过程逐渐形成蚀坑(闭塞电池),而后加速腐蚀
-由于钝化膜的破坏引起
四、晶间腐蚀
●定义:Intergranular Corrosion
金属材料在特定的腐蚀介质中沿着材料的晶粒边界或晶界附近发生腐蚀,使晶粒之间丧失结合力的一种局部破坏的腐蚀现象。
发生晶间腐蚀的电化学条件
(1)内因
——晶粒和晶界区的组织不同,电化学性质存在显著差异。
(2)外因
——晶粒和晶界的差异要在适当的环境下才能显露出来。
晶间腐蚀的特点
●危害性很大
-宏观上可能没有任何明显的变化
-但材料的强度几乎完全丧失
-经常导致设备的突然破坏
●应力腐蚀开裂的起源
-晶间腐蚀常常会转变为沿晶应力腐蚀开裂,成为应力腐蚀裂纹的起源
●有效利用
-在极端的情况下,可以利用材料的晶间腐蚀过程制造合金粉末
晶间腐蚀的原因
●金属和合金处于特定的腐蚀介质中时,晶界和晶粒本体就会显现出不同的电化学特性。
●晶界和晶粒的电化学不均匀性,构成腐蚀原电池。
-晶界为阳极
-晶粒为阴极
●由于晶界的面积很小,构成“小阳极-大阴极”
晶间腐蚀机理
1. 贫Cr理论—晶界碳化物析出
为什么Ni-Cr不锈钢敏化处理后出现严重的晶间腐蚀?
敏化处理(427-816度保温缓冷)
——晶界析出连续的M23C6的碳化物,使晶界产生严重的贫Cr区。
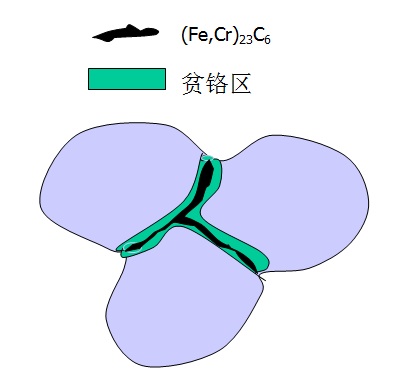
●碳化物沿晶界析出并进一步生长
--》C和Cr依靠由晶内向晶界扩散
--》C扩散>Cr:固溶体内几乎所有的C都用于生成碳化物,只有晶界附近的Cr能参与碳化物的生成反应
--》在晶界附近形成一条贫Cr带,Cr含量低于发生钝化所需的12%。
--》贫Cr带的Cr含量低
--》在弱氧化性介质中:
.晶界贫Cr区为处于活化状态的阳极区,快速溶解
.不贫Cr的晶粒内处于钝化的阴极区
--》贫Cr区为小阳极,晶粒内为大阴极,腐蚀速度显著加快
--》贫Cr区:150~200nm(18-8)
●铁素体不锈钢
-晶界上析出Cr的C、N化物,(Cr,Fe)7C3
-C、N在铁素体中固溶度更小,Cr在铁素体中扩散速度更大——Cr的C、N化物容易在晶界析出
●高强铝合金(Al-Cu,Al-Cu-Mg)
-工业大气、海洋大气、海水环境
-晶界析出CuAl2或Mg2Al3——形成贫Cu或贫Mg区
●镍基合金
-Ni-Mo:沿晶界板出Ni7Mo6_贫Mo
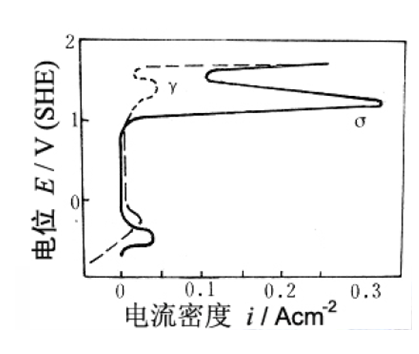
2. 阳极相理论—晶界σ相析出并溶解
超低碳不锈钢(由于碳化物析出引起的晶间腐蚀减少),特别是高Cr、Mo钢在650-850 受热后,在强氧化性介质中仍会产生晶间腐蚀。
.在晶界形成了由FeCr或MoFe金属间化合物组成的 相
.在过钝化-即强氧化的条件下,σ相发生严重的选择性溶解。
.Cr、Mo、Nb、Ti会促使σ相形成
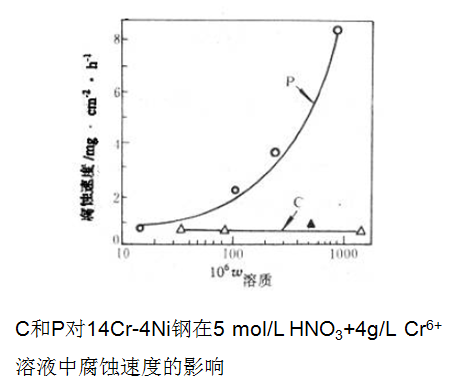
3. 吸附理论—杂原子在晶界吸附
超低碳18Cr-9Ni不锈钢在1050℃固溶处理后,在强氧化性介质中(如硝酸加重铬酸盐)中也会出现晶间腐蚀,无法用前面两理论解释。
P和Si等在晶界发生吸附,使得晶界的电化学特性发生了改变

4. 应力论
晶间腐蚀趋势源于第二相沉淀时产生的内应力。
具有巨大内应力的畸变区在腐蚀介质中显示为优先溶解的阳极行为。
快冷和退火处理可以减少第二相的生成,从而抑制了晶间腐蚀
影响因素
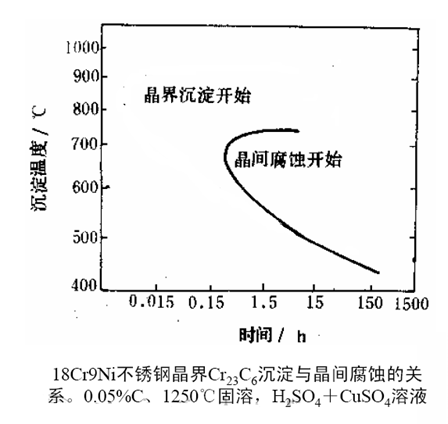
●加热温度和时间-TTS(Temperature-Time-Sensitivity)曲线
.750℃以上时:析出不连续颗粒,Cr扩散也容易,不产生晶间腐蚀;
.600-700℃之间:析出网状Cr23C6,晶间腐蚀最严重;
.低于600℃:Cr、C扩散缓慢,需要更长时间才能形成碳化物,晶间腐蚀减弱;
.低于450℃:难于晶间腐蚀。
●合金成分
.C:
奥氏体不锈钢中含碳量越高,产生晶间腐蚀倾向的加热温度和时间范围扩大,TTS曲线左移,晶间腐蚀倾向越大。
.Cr、Mo
Cr、Mo含量增高,降低C的活度,减轻晶间腐蚀倾向;
.Ni、Si
Ni、Si等非碳化物形成元素,提高C的活度,降低C在奥氏体中的溶解度,促进C的扩散和碳化物的析出。
.Ti、Nb:
Ti和Nb是非常有益的元素。Ti和Nb与C的亲合力大于Cr与C的亲合力,在高温下先于Cr形成稳定的TiC和NbC,从而大大降低了钢中的固溶C量,使Cr23C6难以析出。
Ti和Nb使TTS曲线右移,降低晶间腐蚀倾向。
.B:
在不锈钢中加入0.004-0.005%的B可使TTS曲线右移,B在晶界的吸附减少了C、P在晶界的偏聚
控制措施
1.降低含碳量:
低碳不锈钢,甚至是超低碳不锈钢,可有效减少碳化物析出造成的晶间腐蚀。
早期:18Cr-9Ni:0.20%C,极易晶间腐蚀
后期:C:0.08% - 0.03%
2.合金化:在钢中加入Ti或Nb,板出TiC或NbC,避免贫Cr区的形成。通过调整钢的成分,形成双相不锈钢,如在奥氏体中加入5~10%的铁素体。由于相界的能量更低,碳化物择优在相界析出,从而减少了晶界的沉淀。
3.适当的热处理
对含碳量较高(0.06-0.08%)的奥氏体不锈钢,要在1050-1100 进行固溶处理;
对铁素体不锈钢在700-800 进行退火处理;
加Ti和Nb的不锈钢要经稳定化处理。
五、不锈钢焊缝腐蚀
.固溶处理的奥氏体不锈钢
.腐蚀区-母材板上离焊缝有一定距离的一条带上
.原因
.焊接过程中,该带上经受了敏化加热,引起Cr的碳化物析出

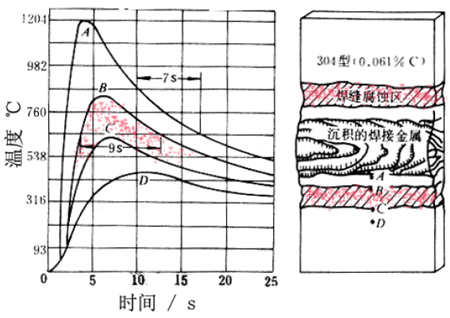
六、不锈钢刀线腐蚀
.加Ti、Nb稳定化处理的不锈钢
.腐蚀区
-在临近焊缝的金属窄带上发生严重的腐蚀而成为深沟
.原因
-焊接时,临近焊缝处与熔融金属接触,温度达950-1400℃,钢中的M23C6、TiC、NbC全部溶解
-二次加热时(双面焊、焊后退火),又重新沿晶界沉淀:贫Cr或枝晶MC溶解

七、剥蚀
——概念
剥蚀又称层蚀,腐蚀沿平行于表面的平面(晶界)萌生,逐步发展,最终使金属剥落基体,呈现层状形貌。
——原理
金属具有层状晶粒结构,由于腐蚀体积膨胀效应,沿晶界产生压应力,随着应力增加,使片状晶粒膨胀鼓起,最终使表面剥落。
——产生剥蚀的条件
(1)合金具有晶间腐蚀倾向
(2)合金具有一定的层状结构
(3)适当的腐蚀介质,如氨类、NO3-、H2O2等
——剥蚀的控制方法
(1)改用没有层蚀的合金
(2)使用热处理方法,减小晶间腐蚀
(3)采用表面保护措施
(4)采用牺牲阳极的阴极保护方法
八、 选择性腐蚀
.定义:Dealloying
指在多元合金中较活泼组分的优先溶解,这个过程是由于合金组分的电化学差异而引起的。
.特点:
在二元或多元合金中,较贵的金属为阴极,较贱的金属为阳极,构成成分差异腐蚀原电池,贵的金属保持稳定或与较活泼的组分同时溶解后再沉积在合金表面,而较贱的金属发生溶解。
.比较典型的选择性腐蚀是黄铜脱锌和铸铁的石墨化腐蚀。
黄铜脱锌
.黄铜:Cu-Zn合鑫
- 加Zn可提高Cu的强度和耐冲蚀性能
- 随Zn含量的增加,脱锌腐蚀和应力腐蚀将变得严重
- 黄铜脱锌即是Zn补选择性溶解,留下了多孔的富Cu区
- 导致合金强度大大下降
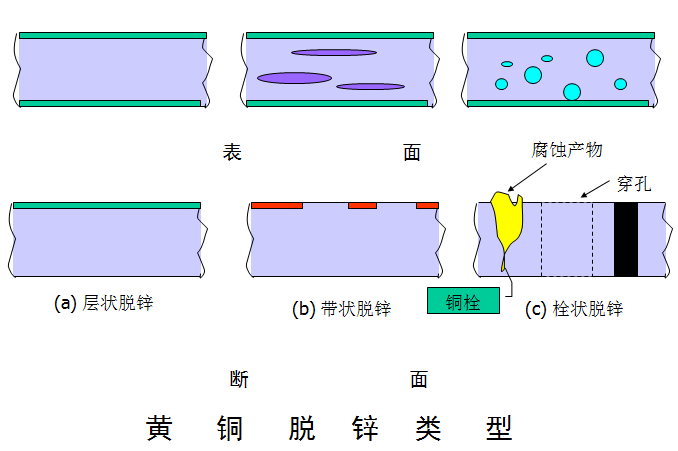
.脱锌形态
- 均匀型或层状腐蚀
.Zn含量较高的合金,酸性介质
- 塞状脱锌
.Zn含量较低的黄铜,中性、碱性和弱酸介质
.海水热交换器
影响因素
.Zn含量的影响
-α黄铜(Zn在Cu中的固溶体合金)
.Zn<15%,红铜,换热器,不发生脱锌
.Zn 30-33%,制作弹壳
-α+β黄铜(β:CuZn金属间化合物)
.Zn 38-47%
.加工性能好,热交换器,脱锌较严重
-导致合金强度大大下降

温度对三种黄铜腐蚀的影响
(在2N NaCl溶液中,经24天水线试验)

机理解释
(1)锌的选择性溶解
这种理论认为,黄铜表面的锌原子发生选择性溶解,留下空位,稍里面的锌原子通过扩散到发生腐蚀的位置,继续发生溶解,结果留下疏松多孔的铜层。
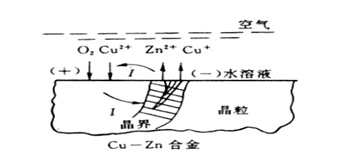
(2)溶解—沉积
这种理论认为铜和锌以金属离子形式一起进入溶液,铜离子再发生还原以纯铜的形式沉积出来(称为回镀)。
(1)黄铜溶解
(2)Zn离子留在溶液中
(3)Cu镀回基体上
.阳极反应:Zn→Zn2+ +2e,Cu→Cu+ +e
.阴极反应:O2+2H2O+4e → 4OH-
.Zn2+留在溶液中,而Cu+与溶液中氯化物作用形成Cu2Cl2,并分解:
Cu2Cl2 → Cu+CuCl2
.Cu2+参加阴极反应 Cu2++2e→Cu Cu又沉淀到基体上
.总的效果是Zn溶解,留下多孔的Cu
防止脱锌的措施
●改善环境
——脱氧或阴极保护


