金属腐蚀之电化学腐蚀的原理与防护
本文主要讲述了金属腐蚀的定义及分类,理解金属腐蚀的化学原理,分清化学腐蚀与电化学腐蚀的区别和联系,金属防护的常用方法,以及防止金属腐蚀的重要意义。

金属的腐蚀现象非常普遍:
1、钢铁生锈: 铁锈的主要成分: Fe2O3·XH2O
2、铜器表面生成铜绿: 铜绿的主要成分: Cu2(OH)2CO3
金属腐蚀的危害有哪些?
中国航天工业总公司第三十一研究所近日公布了一组数据:
◆全球每一分钟就有1吨钢腐蚀成铁锈.
◆全球每年钢铁腐蚀的经济损失约100000亿美元,占各国国民生产总值的2%~4%,我国钢铁腐蚀经济损失高达2800亿人民币,约占国民生产总值的4%,每年约有30%的钢铁因腐蚀而报废。腐蚀给人类造成的损失是惊人的。
◆全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失总和的6倍。
一、金属的腐蚀
1、什么是金属腐蚀?
指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
2、金属腐蚀的本质是什么?
是金属本身失去电子变成阳离子的过程 (发生氧化反应)。 M - ne- = Mn+

升温可加速金属腐蚀

潮湿的环境可促进金属腐蚀
3、金属腐蚀的类型有哪些?——根据与金属接触的介质不同
化学腐蚀: 金属跟接触到的干燥气体(如SO2、Cl2、 O2等)或非电解质溶液(石油)等直接发生化学反应而引起的腐蚀。
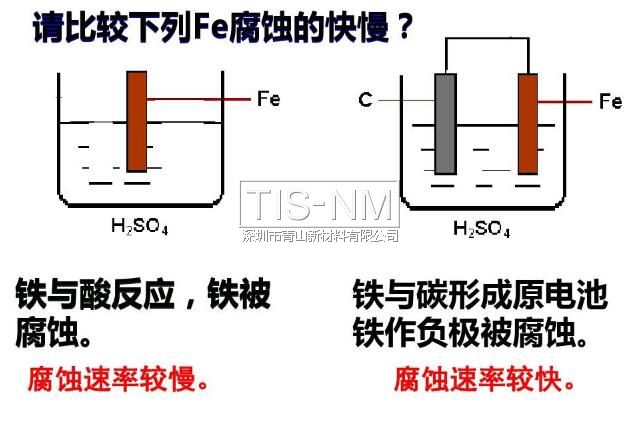
电化学腐蚀:不纯的金属与电解质溶液接触时,发生原电池反应,比较活泼的金属失去电子被氧化。
金属的腐蚀以电化学腐蚀为主
电化学腐蚀

在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜。水膜中溶解有来自大气中的CO2、SO2、H2S等气体,使水膜中含有一定量的H+
H2O + CO2 → H2CO3 → H+ + HCO3- H2O → H+ + OH-
这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳构成无数微小的原电池。
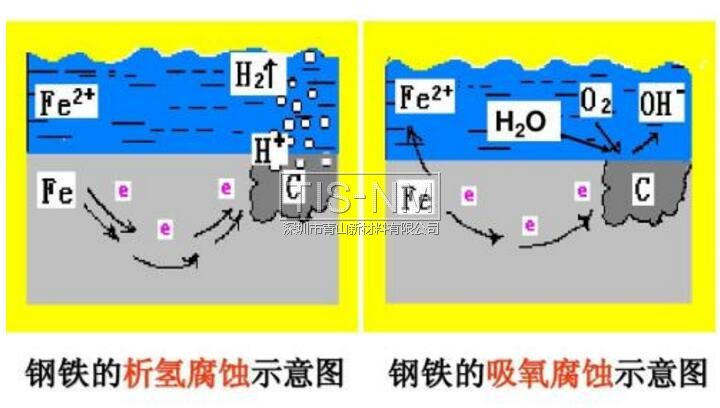 钢铁的析氢腐蚀和吸氧腐蚀比较
钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀 | 吸氧腐蚀 | ||
条件 | 水膜呈酸性 | 水膜呈碱性、中性或弱酸性 | |
电极反应 | 负极 正极 总反应 | Fe-2e-=Fe2+ 2H++2e-=H2↑ Fe+2H+=Fe2++H2↑ | 2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH- 2Fe+2H2O+O2=2Fe(OH)2 4Fe(OH)2+2H2O+O2= 4Fe(OH)3 ↓ Fe2O3·nH2O(铁锈) |
联系 | 通常以电化学腐蚀为主,其中又以吸氧腐蚀更普遍。 | ||
二、金属的防护
1、原理 防止金属失电子
2、电化学防护
(1)牺牲阳极保护法
形成原电池反应时,负极材料很快被腐蚀,而正极材料不容易被腐蚀(被保护)。
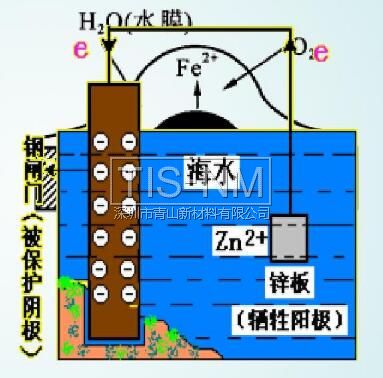
(2)外加电流的阴极保护法
将被保护金属作为电解池的阴极,另一导电物质作为阳极,在外加直流电的作用下使阴极得到保护
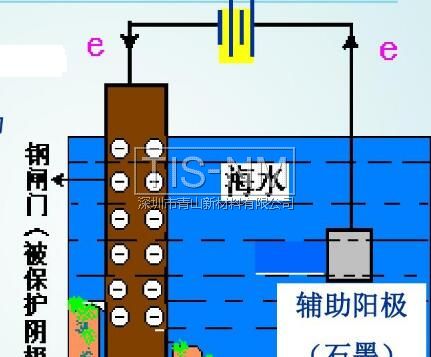
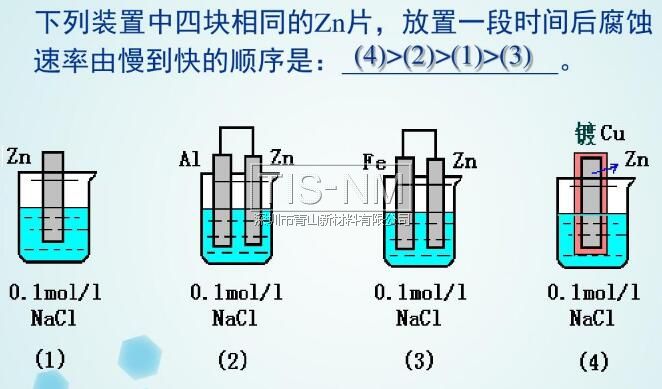
在同一电解质溶液中,金属腐蚀的快慢:
电解池的阳极 > 原电池的负极 > 化学腐蚀 > 原电池的正极 > 电解池的阴极
防腐措施由好到坏的顺序如下:
外接电源的阴极保护法 > 牺牲阳极的阴极保护法 > 有一般防腐条件保护 > 无防腐条件
以Fe片为例,不同的防腐措施下腐蚀变化速度是不同的:
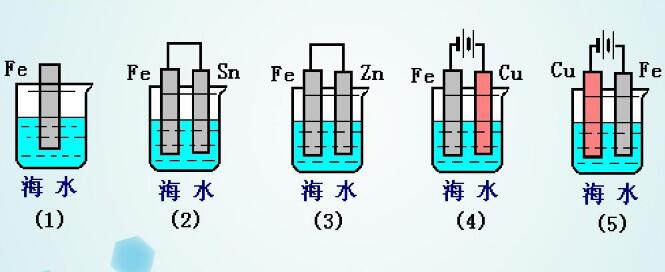
Fe片腐蚀由快到慢的顺序
3、金属的常见防护方法
(1)在金属表面覆盖保护层。
例如:喷涂漆;涂油脂;表面钝化;电镀(在钢铁表面形成铬等耐腐蚀性较强的金属镀层)等。
(2)改变金属内部的组成结构,制成合金。
在钢铁中加入一定比例的铬和镍,改变钢铁内部的组成和结构,可极大程度地提高钢铁抗腐蚀性能,这就是常见的“不锈钢”(合金)。
比如自行车车身部件通常都采用了以下的防腐措施:

Zn片在不同防护措施下的腐蚀速度对比